关于就《专利审查指南修改草案(第一批征求意见稿)》公开征求意见的通知
2020-10-10浏览次数:
来源:国家知识产权局
(版权归原作者所有,本文仅供交流学习,部分文章推时未能及时与原作者取得联系,若来源标注错误或侵犯到您的权益,烦请告知,我们将立即删除)
封面图片来自网络
关于就《专利审查指南修改草案(第一批征求意见稿)》公开征求意见的通知
为全面贯彻习近平总书记关于加强知识产权保护的一系列指示精神,深化落实“放管服”改革的决策部署,积极回应经济科技快速发展对审查规则的新诉求,提高专利审查质量和审查效率,2020年国家知识产权局开展《专利审查指南》全面修改工作。此次修改涉及内容较多,本着“成熟一批、公布一批”的原则,现将《专利审查指南修改草案(第一批征求意见稿)》(以下简称“第一批征求意见稿”)及其说明予以公布,征求社会各界意见。有关单位和各界人士可以在2020年11月15日前,选择以下方式中的一种,围绕第一批征求意见稿的修改完善提出具体意见:
1. 电子邮件:tiaofasi@cnipa.gov.cn
2.传真:010-62083681
3.信函:北京市海淀区西土城路6号国家知识产权局条法司审查政策处 邮编100088(请于信封左下角注明“审查指南”)
附件1:《专利审查指南修改草案(第一批征求意见稿)》修改对照表
附件2:关于《专利审查指南修改草案(第一批征求意见稿)》的说明
附件1:
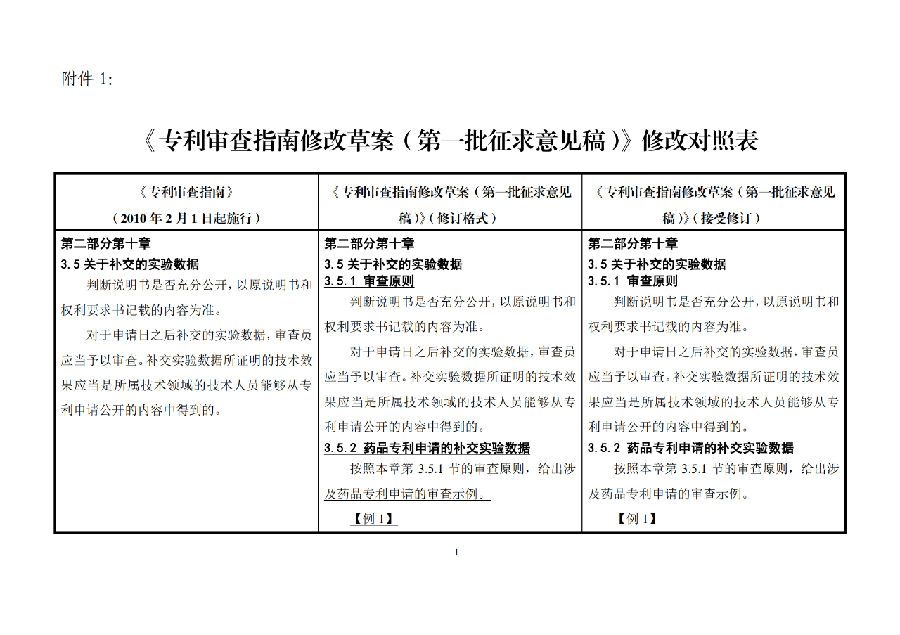
《专利审查指南修改草案(第一批征求意见稿)》修改对照表



















附件2:
关于《专利审查指南修改草案(第一批征求意见稿)》的说明
一、修改背景
为全面贯彻习近平总书记关于加强知识产权保护的一系列指示精神,深化落实“放管服”改革的决策部署,积极回应经济科技快速发展对审查规则的新诉求,提高专利审查质量和审查效率,国家知识产权局不断完善专利审查标准,为创新主体提供有力制度保障。
2020年5月,国家知识产权局启动《专利审查指南》(下称《指南》)全面修改工作。此次修改是在充分调研社会主体需求、总结审查实践经验的基础上开展的。
《专利审查指南修改草案(第一批征求意见稿)》内容涉及《指南》第二部分第十章。
二、主要修改内容
(一)与补交实验数据有关的修改(第二部分第十章第 3.5节)
此次修改在 2017 年《国家知识产权局关于修改<专利审查指南>的决定》(国家知识产权局令第 74 号)相关修改内容的基础上,新增一个小节,通过典型案例对药品专利申请的补交实验数据问题予以进一步规范。将《指南》第二部分第十章第 3.5 节进一步分为第 3.5.1节和第 3.5.2 节。
一方面,《指南》第 3.5 节的内容移至第 3.5.1节,作为补交实验数据的一般“审查原则”。
另一方面,增加第 3.5.2 节“药品专利申请的补交实验数据”,给出两个审查示例,分别涉及说明书充分公开和创造性审查中有关补交实验数据的典型情形。
通过两个具体案例进一步明确审查中对于申请日后提交的效果实验数据的审查标准,规范了如何综合考虑申请文件公开的内容和现有技术状况,站位所属技术领域的技术人员判断其所证明的技术效果是否能够从专利申请公开的内容中得到。
(二)关于组合物权利要求的其他限定的修改(第二部分第十章第 4.2.3 节)
现行《指南》规定:“如果在说明书中仅公开了组合物的一种性能或者用途,则应写成性能限定型或者用途限定型”,本次修改将“则应”调整为“通常需要”,以明确是否需要进行性能限定或用途限定应结合具体情况具体分析,有利于维护申请人正当权益。此外,对文字进行了适应性调整。
(三)关于化合物的新颖性的修改(第二部分第十章第 5.1节)
本次修改厘清了“提及即公开”和“推定不具备新颖性”二者之间的关系和界限,明确了相关举证责任。
针对第 5.1 节(1)第一段涉及的“提及即公开”的情形,修改方案仅保留与结构信息有关的内容,并要求信息的披露程度达到“使所属技术领域的技术人员认为要求保护的化合物已经被公开”,删除“推定”二字以达到明显区分两种情形的目的。
针对第 5.1 节(1)第二段和第三段“推定不具备新颖性”的情形,第一,删除“例如”,使得“推定不具备新颖性”情形不再作为“提及即公开”情形的举例出现;第二,把参数和制备方法等因素合并,增加“效果实验数据”,提出应综合考虑这些因素,并且考虑的结果是要达到所属技术领域的技术人员有理由推定权利要求化合物与对比文件化合物实质相同的程度,举证责任才能转移给申请人;第三,采用“有理由推定二者实质相同”的表述强调审查员应关注推定的合理性以及审查意见的说理充分;第四,将但书部分修改为“除非申请人能提供证据证明结构确有差异”以符合这类推定的举证要求。
(四)关于化合物的创造性的修改(第二部分第十章第 6.1节)
现行《指南》关于化合物创造性审查的规定比较绝对,过度关注化合物的技术效果是否预料得到,而忽视对化合物本身是否非显而易见的审查,可能影响创造性审查结论的准确性。本次修改回应了产业诉求,完善了化合物创造性的审查标准。
1. 明确三步法对化合物创造性判断的指导作用
本次修改在第 6.1 节的第一段按照“三步法”的要求理顺化合物创造性的判断思路,旨在引导审查员在进行创造性判断前,首先需要理解发明、了解现有技术、把握结构改造与用途和/或效果之间的关系,确定发明实际解决的技术问题,在站位本领域技术人员的基础上,再去判断现有技术是否存在相应的技术启示,进而得出准确的创造性审查结论。
本次修改还明确了如果所属技术领域的技术人员在现有技术的基础上仅仅通过合乎逻辑的分析、推理或者有限的试验就可以进行结构改造,得到要求保护的化合物,则认为现有技术存在技术启示。
2. 明确“预料不到的技术效果”的定位
本次修改将“预料不到的技术效果”回归《指南》第四章中相应规定的本意,突出其与“三步法”之间的内在逻辑联系。
3.修改原有化合物创造性判断示例并补充新的示例
本次修改在第 6.1 节(1)-(3)之后,设臵第 6.1 节(4)“化合物创造性判断示例”,通过 5 个案例说明化合物创造性判断思路,侧重以“三步法”的评判逻辑指导化合物创造性审查。
案例的分析与第 6.1 节(1)内容呼应,结合化学领域特点,强调对于结构改造与用途和/或效果的关系把握,是正确判断现有技术有无启示的前提和基础。
其中,【例 1】-【例 3】在《指南》原有案例基础上进行改写,以与“三步法”的精神和思路保持一致。
新增【例 4】与【例 3】形成鲜明对照,两个案例均涉及采用经典电子等排体臵换的结构改造,但是二者创造性评判结论完全相反,突出了在化合物创造性判断中把握结构改造与发明效果和/或作用之间的关系,是得出正确审查结论的前提。
新增【例 5】涉及通式化合物及其中的一个具体化合物的创造性判断过程。该案例旨在说明如果权利要求保护范围不同,则相对于最接近现有技术的结构差异不同,基于这种结构改造所获得的用途和/或效果可能也会随之不同,进而得出不同的创造性审查结论。
(五)关于生物材料保藏单位的修改(第二部分第十章第9.2.1 节(4))
依照《根据布达佩斯条约保藏微生物指南》(2017 年 3 月),我国被布达佩斯条约承认的生物材料样品国际保藏单位新增位于广州的广东省微生物菌种保藏中心(GDMCC)。据此进行适应性修改。
(六)关于单克隆抗体权利要求撰写的修改(第二部分第十章第 9.3.1.7 节)
随着单克隆抗体测序技术的成熟和普及,获得单克隆抗体的结构信息变得更加容易。目前单克隆抗体权利要求主要以序列结构表征单克隆抗体。此次修改在“杂交瘤限定”方式之前增加“结构特征限定”方式,并举例进行了说明。
(七)关于生物技术领域发明的创造性的修改(第二部分第十章第 9.4.2 节)
修改对于“预料不到的技术效果”过于绝对的表述方式,明确生物技术领域发明创造性审查的基本原则和方式,规范第9.4.2 节中各保护主题的创造性审查思路。既体现了“三步法”的审查思路,也丰富了技术主题,适应科技进步,回应产业诉求,服务创新发展。
1. 完善“基因”“重组载体”“转化体”“单克隆抗体”中具体情形的创造性评判标准(第 9.4.2.1 节)
在“基因”主题中,增加结构基因创造性判断的一般标准,给出具备创造性的情形,体现“三步法”在结构基因创造性评判中的适用方式。同时,原有“某蛋白质的氨基酸序列是已知的”和“某蛋白质已知而其氨基酸序列是未知的”两类情形中,具备创造性的规定的表述完全一致,且这两类情形存在逻辑上的联系,因此将其合并表述,使得语言精炼,逻辑连贯。
在“重组载体”主题中,增加针对载体和/或插入的基因结构改造获得的重组载体具备创造性的情形,体现“三步法”在重组载体创造性评判中的适用方式。
在“转化体”主题中,增加针对已知宿主和/或插入基因的结构改造获得的转化体具备创造性的情形,体现“三步法”在转化体创造性评判中的适用方式。
在“单克隆抗体”主题中,增加以结构特征限定的单克隆抗体创造性判断的示例,强调重点关注决定功能和用途的关键序列结构的结构差异。同时,针对已知抗原限定的单克隆抗体以及采用杂交瘤表征的单克隆抗体的相关规定做了澄清性修改,明确“预料不到的技术效果”在此类发明创造性评判中的适用情形。
2. 补充“多肽或蛋白质”主题中具体情形的创造性评判标准
在“基因”主题之后,增加“多肽或蛋白质”主题。该主题在审查实践中相关案例较多,且具有自身技术特点。在此规定了多肽或蛋白质创造性判断的一般标准,给出具备创造性的情形,体现“三步法”在多肽或蛋白质创造性评判中的适用方式。






